아치마이신 분산 영화
적응증
중이염, 비두염, 인두염, 편도염 등 호흡기 감염, 기관지염, 폐렴 등 호흡기 감염.피부와 소프트 조직 감염, 모래 눈의 원체 는 단순성 생식기 감염, 비다중내약 이 구균에 미치는 단순성 생식기 감염(메소나선체의 합병 감염을 제거해야 한다.
임상 약리
아치니실린은 질소 잡내에스테르 항생제로 작용하는 기능은 민감미생물의 50s 핵 단위와 결합하여 단백질의 합성을 방해한다.체외실험과 임상연구에 따르면 아치마이신은 이하의 여러 가지 발병균에 항균 작용을 한다: 혁란 양성 수요산소 미생물: 황금색 포도 구균, 숙연 구균, 폐렴 체인 구균, 용혈성 체인균.아치마이신은 페니실린을 내는 혁란 양성균에 교차 내약성이 있다.대다수 분자 체인 구균(장구균)과 나산시림의 포도 구균은 본품에 내약.혁란의 음성 수요 산소 미생물: 독감 기혈균, 카타모라균, 모래눈 지원체.체외실험과 임상연구는 알키마이신 내분배균복합체 (새세포 내분지균과 세포 내분지균으로 구성돼 발생한 질병을 확인했다.아치마이신은 베타아미드의 균주에 효력이 없다.연구에 따르면 아키실린은 이하 미생물에 체외항균 작용이 있지만, 임상 의의는 아직 분명하지 않다. 체인 구균(C, F, G), 초록색 체인 구균, 백일기균, 두크 기혈균, 기혈성 군단균, 류균, 체인균, 소화 체인, 폐렴 원체, 매독 나선체, 해독 원체 등을 포함한다.
용법 용량
본 제품은 직접 물로 삼키고 적당량의 온도를 넣고 물에 잘 섞여 복용할 수 있습니다.(자세한 설명서)
제형
분산 영화
규격
0.25g
설명서
날짜를 비준하다 2007년 05월 08일
수정 날짜 2010년 10월 01일
2013년 12월 11일 2015-11-25 포장 규격 증가
아치마이신 분산 설명서
설명서를 자세히 읽고 의사의 지도하에 사용하십시오
약품 명칭
일반 이름 : 아지트로 마이신 분 산성 정제
상품 이름: 군결
영어 이름: Azithromycin Dispersible Tablets
중국어 병음 : Aqimeisu Fensanpian
[성분]이 제품의 주요 성분은 아지트로 마이신입니다.
화학명 : (2R, 3S, 4R, 5R, 8R, 10R, 11R, 12S, 13S, 14R) -13-[(2,6- 디데 옥시 -3-C- 메틸 -3-O- 메틸- α-L- 핵-헥사 라노 실) 옥시] -2- 에틸 -3,4,10- 트리 하이드 록시 -3,5,6,8,10,12,14- 헵타 메틸 -11- [ [3,4,6,-트라이 드 옥시 -3- (디메틸 아미노) -β-D- 우드-피라 노실] 옥시] -1- 옥사 -6- 아자 사이클로 펜타 데칸 -15 온 .
화학 구조 :
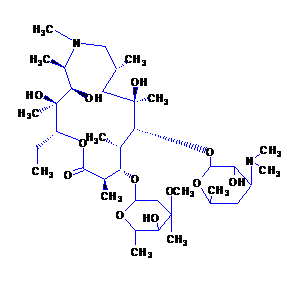
분자식 : C38H72N2O12
분자량 : 749.00
【속성】이 제품은 흰색 또는 회백색입니다.
[표시]이 제품은 민감한 박테리아로 인한 다음 감염에 적합합니다.
중이염, 부비동염, 인두염, 편도선염과 같은 상부 감염; 기관지염 및 폐렴과 같은 하부 호흡기 감염. 피부 및 연조직 감염; 클라미디아 트라코마 티스 (Chlamydia trachomatis)에 의한 단순 생식기 감염; 비 약물 내성 임균성 박테리아에 의한 단순 생식기 감염 (멜 팔란 종의 재조합 감염).
【사양】 0.25g
[용도 및 복용량] 전염병 치료, 치료 및 사용 과정에 대한 아지트로 마이신 정제는 다음과 같습니다.
이 제품은 물로 직접 삼키거나 적절한 양의 따뜻한 물에 넣고 잘 섞어서 복용하십시오.
성인 : 클라미디아 트라코마 티스 또는 민감한 임균균으로 인한 성병은 단일 용량으로이 제품의 1.0g (4 정) 만 섭취하면됩니다.
다른 감염의 치료 : 총 복용량은 1.5g (6 정), 하루에 한 번이 제품의 0.5g (2 정)의 3 가지 복용량으로 나뉩니다. 또는 총 복용량은 동일하지만, 여전히 1.5g (6 정), 첫날 0.5g (2 정)을 섭취 한 다음이 제품의 0.25g (1 정)을 하루에 한 번 2 ~ 5 일 동안 복용하십시오.
【이상 반응】
(1) 임상 시험 경험
임상 시험은 다른 조건 하에서 수행되기 때문에 임상 시험에서 관찰 된 한 약물의 부작용은 임상 시험에서 다른 약물의 부작용과 직접 비교 될 수 없으며 실제 응용 분야에서 부작용을 반영하지 않을 수 있습니다. 요율.
커뮤니티-취득 폐렴에 대한 아지트로 마이신 정맥 내 제제의 임상 시험에서, 2 내지 5 회 용량을 정맥 내로 투여하였고,보고 된 이상 반응의 대부분은 경증 내지 중등도 였고, 약물을 중단 한 후 회복되었다. 이 임상 시험에서 대부분의 환자는 하나 이상의 동반 질환이 있으며 다른 약물을 적용해야합니다. 이 제품의 정맥 주사를받은 환자의 약 1.2 %는 약물 치료를 중단했으며, 정맥 또는 경구 아지트로 마이신으로 치료받은 환자의 2.4 %는 부작용 반응 또는 비정상적인 실험실 검사로 약물 치료를 중단했습니다.
골반 염증성 질환 환자의 임상 시험에서, 아지트로 마이신 단독 요법을받은 환자의 2 %가 정맥 내 약물 투여를 받았으며, 임상 부작용으로 인해 중단 된 환자의 2 %, 아지트로 마이신 및 메트로니다졸이있는 환자 환자의 4 %가 부작용으로 인해 치료를 중단했습니다.
위의 연구에서 약물의 중단으로 이어지는 가장 흔한 부작용은 위장 반응 (복통, 메스꺼움, 구토, 설사 등)과 발진이었으며, 아미노 트랜스퍼 라제 및 / 또는 알칼리성 포스파타제의 중단에 대한 비정상적인 실험실 검사로 이어졌습니다. 높음
지역 사회 획득 폐렴 연구에서, 정맥 / 경구 제제를받는 성인 환자에서 가장 흔한 부작용은 설사 또는 대변 (4.3 %), 구역 (3.9 %) 및 복통 (2.7)을 포함한 위장 반응이었습니다. %), 구토 (1.4 %). 환자의 약 12 %가 정맥 주사와 관련된 부작용을 보였으며, 가장 흔한 것은 주사 부위 통증 (6.5 %) 및 국소 염증 반응 (3.1 %)입니다.
골반 염증성 질환이있는 환자의 임상 시험에서, 성인 여성 환자는이 제품의 정맥 / 경구 제제를 투여받습니다. 치료와 관련된 가장 일반적인 부작용은 위장 반응이며, 그중 설사 (8.5 %)와 구역 (6.6)이 일반적입니다. %), 질염 (2.8 %), 복통 (1.9 %), 식욕 부진 (1.9 %), 발진 및 가려움증 (1.9 %)이 뒤 따릅니다. 이 연구에서, 아지트로 마이신과 메트로니다졸의 조합은 메스꺼움 (10.3 %), 복통 (3.7 %), 구토 (2.8 %), 투여 부위, 구내염, 현기증 및 호흡 곤란이있는 여성 환자에서 더 많이 발생했습니다. 1.9 %).
아지트로 마이신 정맥 내 / 경구 다중-용량 요법에 의해 야기 된 다른 부작용은 1 %를 초과하지 않았다.
발생률이 1 % 이하인 이상 반응은 다음과 같습니다.
위장 반응 : 소화 불량, 팽만감, 점막염, 구강 칸디다증 및 위염.
신경계 : 두통, 무기력.
알레르기 반응 : 기관지 경련.
특별한 느낌 : 맛이 잘못되었습니다.
(2) 상장 후 신청 후 경험
경구 아지트로 마이신 제제는 마케팅 후 성인 및 / 또는 아동 환자에게 사용되며, 다음과 같은 부작용이보고되었지만 아지트로 마이신이 원인인지 확실하지 않습니다.
알레르기 : 관절통, 부종, 두드러기, 혈관 부종.
심혈관 : 부정맥에는 심실 빈맥, 저혈압, 드문 QT 간격 연장 및 심실 빈맥 빈맥이 포함됩니다.
위장관 : 식욕 부진, 변비, 소화 불량, 팽만감, 구토 / 설사지만 탈수, 가임 성 대장염, 췌장염, 구강 칸디다증, 유문 협착 및 희소 한 혀 변색을 거의 일으키지 않습니다.
전신 반응 : 피로, 감각 이상, 피로, 불편 및 과민성 쇼크 반응.
비뇨 생식기 : 간질 성 신염, 급성 신부전, 질염.
조혈 시스템 : 혈소판 감소증.
간 / 담도 : 간 기능 장애와 관련된 부작용은 시판 후 아지트로 마이신의 경험에서보고되었습니다.
신경계 : 경련, 현기증 / 현기증, 두통, 혼수, 과잉 행동, 신경질, 동요 및 실신.
비정상적인 귀 및 손실 : 청각 장애, 이명, 청력 손실, 현기증.
정신 : 공격적인 반응과 불안.
피부 및 액세서리 : 가려움증, 다형 홍반, 스티븐스 존슨 증후군 및 독성 표피 괴사를 포함한 희귀하고 심한 피부 반응.
특수 감각 : 청각 장애에는 청각 상실, 귀 먹음 및 / 또는 이명, 미각 / 후각 이상 및 / 또는 상실에 대한보고가 포함됩니다.
실험실 검사 이상 :
임상 시험에서 볼 수있는 중요한 실험실 검사 (약물과 관련이 있든 없든)는 다음과 같습니다
발생률은 4 % 내지 6 % : 알라닌 아미노 트랜스퍼 라제 (ALT), 아스파 테이트 아미노 트랜스퍼 라제 (AST) 및 크레아티닌이다.
발생률은 1 % ~ 3 %입니다. 젖산 탈수소 효소 (LDH)와 빌리루빈이 증가합니다.
백혈구 감소증, 호중구 감소증, 혈소판 수 감소 및 혈청 알칼리성 포스파타제 증가의 발생률은 1 % 미만입니다.
추적 관찰은 상기 실험실 이상이 가역적임을 발견했다.
750 명 이상의 환자에서 다중 용량의 아지트로 마이신 (정맥 내 / 구강)의 임상 시험에서, 치료 관련 간 효소 이상으로 인해 2 % 이하의 환자가 아지트로 마이신을 중단하지 않았습니다.
[금기]
아지트로 마이신, 에리스로 마이신, 기타 마크로 라이드 또는 케톨 리드에 알레르기가있는 환자에서 금지되는 것으로 알려져 있습니다. 아지트로 마이신 사용 후 담즙 정체 황달 / 간 기능 장애의 병력이있는 환자는 이전에 금지되었다.
경고
알레르기 반응
혈관 부종, 아나필락시스 쇼크 및 스티븐스 존슨 증후군 및 독성 표피 괴사를 포함한 피부 반응을 포함한 심각한 알레르기 반응에 대한보고는 아지트로 마이신 치료에서 드물다. 드물지만 사망에 대한보고가 있습니다. 일부 환자의 경우 알레르기 증상이 처음에 증상 치료를받는 경우 아지트로 마이신을 사용하지 않더라도 조기에 치료를 중단하면 알레르기 증상이 빠르게 재발 할 수 있습니다.
그러한 환자의 증상 치료 및 관찰 시간을 연장해야합니다. 이들 사건의 발생이 조직에서 아지트로 마이신의 긴 반감기 및 신체가 항원에 더 오래 노출되는 것과 관련이 있는지 여부는 알려져 있지 않다.
알레르기 반응이 발생하면 약물을 즉시 중단하고 적절한 치료를 받아야합니다. 의사는 증상 치료를 중단 한 후에 알레르기 증상이 다시 나타날 수 있음을 알아야합니다.
간독성
간 기능 이상, 간염, 황달의 담즙 정체, 간 괴사 및 간부전이보고되었으며, 그 중 일부는 치명적일 수 있습니다. 간염 증상 및 징후가 나타나면이 제품의 사용을 즉시 중단하십시오.
클로스 트리 디움 디피 실레 관련 설사
거의 모든 항균성 약물에는 경증 설사에서 치명적인 대장염에 이르는이 제품을 포함하여 클로스 트리 디움 디피 실레 관련 설사 (CDAD)에 대한보고가 있습니다. 항균 처리는 결장의 정상 식물상에서 변화를 일으켜 클로스 트리 디움 디피 실레의 과도한 번식을 초래합니다.
클로스 트리 디움 디피 실레 (Clostridium difficile)에 의해 생성 된 독소 A 및 독소 B는 CDAD의 발병과 관련이있다. 독성이 높은 C. 디피 실레는 이환율 및 사망률을 증가 시키며, 이러한 감염은 항생제로 치료하기 어려울 수 있고, 전기 요법이 필요할 수 있습니다. 항생제를 사용한 후 설사를하는 모든 환자의 경우 CDAD의 가능성을 고려해야합니다. 2 개월 이상의 항생제 치료 후 CDAD에 대한보고가 있었으므로 병력에 대해 신중하게 문의해야합니다.
CDAD가 의심되거나 진단되면 Clostridium difficile에 사용되지 않는 항생제를 중단해야 할 수도 있습니다. 임상 적 필요에 따라 물, 전해질 및 단백질을 적절히 보충해야하며 클로스 트리 디움 디피 실레 (Clostridium difficile)에 효과적인 항생제를 제공해야하며 필요한 경우 수술 평가를 수행해야합니다.
【주의 사항】
일반 : 아지트로 마이신은 주로 간에서 제거되므로 간 기능 장애가있는 환자는 아지트로 마이신을주의해서 사용해야합니다. GFR이 10mL / min 미만인 대상체는 데이터가 제한적이며, 이러한 환자에서는 아지트로 마이신을주의해서 사용해야합니다. 간 기능 이상, 간염, 담낭 황달, 간 괴사 및 간 부전이보고되었으며 일부는 치명적일 수 있습니다. 간염의 징후와 증상이 나타나면 아지트로 마이신을 즉시 중단해야합니다.
QT 간격 연장
아지트로 마이신을 포함한 다른 마크로 라이드 항생제의 사용은 심실 재분극 및 QT 간격의 연장을 유발하여 부정맥 및 심실 빈맥의 위험을 초래할 수 있다고보고되었다. 아지트로 마이신을 복용 한 환자의 시판 후 감시에서 심실 성 빈맥이 발생한 경우가 자발적으로보고되었다. 고위험군에서 아지트로 마이신 사용의 위험과 이점을 평가할 때 의료 서비스 제공 업체는 다음을 포함하여 치명적인 QT 간격 연장 위험을 고려해야합니다.
· 이미 QT 간격 연장, 첨단 전환형 실성 심쿵 과속 질병, 선천적 QT 간격 연장 종합 증폭, 완만성 심률이 비정상적이거나 대상성 심력쇠진 환자.
· 항 정신병 약, 항우울제 및 플루오로 퀴놀론과 같은 QT 간격 약물을 연장하는 것으로 알려진 환자.
· 교정되지 않은 저칼륨 혈증 또는 저 마그네슘 혈증과 같은 부정맥, 임상 적으로 유의 한 서맥, 유형 IA (퀴니 딘, 프로 카인 아미드) 및 유형 III ( 도페 틸리 드, 아미오다론 및 소탈 롤과 같은 항 부정맥제가있는 환자.
·
노인 환자 : 노인 환자는 약물 관련 QT 간격 효과에 더 민감 할 수 있습니다.
아지트로 마이신-치료 된 환자는 중증 근무력증 또는 새로운 중증 근무력증 증후군의 악화를보고 하였다.
진단이 없거나 박테리아 감염이 의심되는 경우 또는 예방 조치가없는 경우이 제품을 사용하면 환자에게 도움이되지 않을 수 있으며 약물 내성 박테리아의 위험이 증가합니다.
환자는 다음을 알아야합니다.
알레르기 반응의 징후가 나타나면 즉시 아지트로 마이신을 중단하고 의사에게 연락하십시오.
이 제품 (azithromycin)을 포함한 항생제는 박테리아 감염 치료에만 사용할 수 있으며 바이러스 감염 (예 : 감기) 치료에는 사용할 수 없습니다. 박테리아 감염을 치료하기 위해이 제품 (아지 마이신)을 사용하는 경우, 환자는 일반적으로 치료를 시작할 때 기분이 좋아 지지만 정확한 약물 치료를 위해서는 의사의 지시를 따라야한다는 사실을 환자에게 알려야합니다. 세균성 저항 (2)의 증가의 가능성이 내성균을 치료할 수 미래 마이신 또는 다른 항생제로 이어질 처리의 전류 효율 (1) 환원 : 처리의 전 과정이 될 수 완료 부재중 여부.
항생제 치료는 종종 설사를 유발하며, 일반적으로 항생제를 중단 한 후에 회복됩니다. 때때로, 항생제 치료 후, 환자는 마지막 항생제 사용 후 2 개월 또는 그 이상에 물변 또는 피변이있을 수 있습니다 (위 경련 및 열이 있거나없는). 이 경우 환자는 가능한 한 빨리 의사에게 문의해야합니다.
[임산부와 수유부]
동물 생식 독성 연구는 태반을 통해 Mengaai ADM을 보이지 않고 있지만, 태아 손상의 징후했다. 모유에는이 제품의 분비 데이터가 없습니다. 동물 실험 데이터는 인간의 적용을 완전히 예측하지는 않습니다. 임신 및 수유에서의 안전은 지금까지 확인되지 않았으므로 임산부 또는 수유중인 여성에게 적합한 선택이없는 경우이 제품을 사용해서는 안됩니다.
[아동 약물]이 실험은 수행되지 않았으며 신뢰할만한 참고 자료는 없습니다.
[노인 사용]이 실험은 수행되지 않았으며 신뢰할만한 참고 자료는 없습니다.
[약물 상호 작용]
약물 상호 작용 : 넬 피나 비르의 정상 상태에서 단일 용량의 아지트로 마이신의 경구 투여는 아지트로 마이신의 혈청 농도를 증가시킬 수있다. 필요는 넬 피나 비르와 병용 아지트로 마이신의 투여 량을 조정하는,하지만 밀접한 간 효소 이상과 같은 청각 장애 마이신 알려진 부작용을 모니터링해야 않는다.
자발적보고는 나와 아지 스로 마이신의 병용 경구 항응고제의 역할을 향상시킬 수 있음을 시사한다. 아지 스로 마이신 경구 항응고제 환자는 프로트롬빈 시간 면밀히 모니터링해야합니다.
치료 용량, 아지 스로 마이신 아토르바스타틴, 카르 바 마제 핀, 세티 리진, 디다 노신,에 파비 렌즈, 플루코나졸, 인디 나비 르, 미다 졸람, 리파 부틴, 웨스트로 사용되는 경우 디피 리다 몰, 테오필린 (정맥 및 경구 투여), 트리아 졸람, 트리 메토 프림 / 설파 메톡 사졸 또는 지 부부 딘의 약동학은 거의 효과가 없다. 결합 될 때, 아지 스로 마이신의 약동학에 파비 렌즈 또는 플루코나졸은 거의 영향을했다. 임의의 조정없이 이러한 약물, 약물의 투여 량을 임의의 아지 스로 마이신과 조합.
아지트로 마이신은 임상 시험에서 다음 약물과 상호 작용하는 것으로보고되지 않았습니다. 그러나 이러한 약물과 전문 평가 아지 스로 마이신 사이의 잠재적 인 상호 작용은 지금까지 수행되지 않습니다. 그러나 이러한 상황이 나타 났었 다 다른 마크로 라이드에 적용됩니다. 따라서, 새로운 연구 자료가없는 경우, 아지 스로 마이신과 함께 다음과 같은 약물이 밀접하게 환자를 관찰해야하는 경우 :
디곡신의 혈중 농도 - 디곡신.
에르고 사민 또는 디 히드로 에르고 타민-심각한 말초 중독으로 심각한 말초 혈관 경련 및 감각 이상으로 나타납니다.
테르페나딘, 사이클로스포린, 헥소 바르 비탈 및 페니토인 농도.
실험실 테스트에 대한 영향 : 실험실 테스트에 대한 영향에 대한보고는보고 된 바 없습니다.
[약물 과다 복용] 약물 과다 복용의 부작용은 권장 복용량과 동일합니다. 남용이 발생하면 위 세척 또는 일반적인지지 요법과 같은 상태에 따라 증상 및지지 치료가 제공 될 수 있습니다.
【약리학 및 독성학】
약리 작용
아지트로 마이신은 민감한 미생물의 50 년대 리보솜의 서브 유닛에 결합함으로써 단백질의 합성 (핵산 합성에 영향을주지 않음)을 방해하는 작용기 전인 아잘 라이드 항생제이다.
시험관 내 및 임상 연구 모두에서 아지트로 마이신은 다양한 병원성 박테리아에 항균 효과가 있음을 보여주었습니다.
그람 양성 호기성 미생물 : 황색 포도상 구균, 연쇄상 구균, 연쇄상 구균, 연쇄상 구균 용혈.
아지트로 마이신은 에리스로 마이신 내성 그람 양성 박테리아에 대해 교차 내성이다. 대부분의 Streptococcus faecalis (Enterococcus)와 methicillin-resistant Staphylococcus는이 제품에 내성이 있습니다.
그램 음성 호기성 미생물 : Haemophilus influenzae, Moraxella catarrhalis, Mycoplasma trachomatis.
시험 관내 및 임상 연구는 아지트로 마이신이 세포 내 마이 코박 테 리움 복합체 (미코 박테리아 아 비움 및 미코 박테 리움 인트라 셀로 구성)에 의해 야기 된 질병을 예방할 수 있음을 확인 하였다.
아지트로 마이신은 베타-락타 마제를 생산하는 균주에 대해 효과적이지 않다.
연구 결과에 따르면 아지트로 마이신은 다음 미생물에 대해 시험관 내 항균 효과가 있지만 Streptococcus (C, F, G), Streptococcus mutans, Bordetella pertussis, Haemophilus ducrei, Legionella pneumophila 등 임상 적 의의는 여전히 불분명합니다. , 박 테로이 데스, 스트렙토 코커스 뉴 모니 아에, 보렐리 아, 클라미디아 뉴 모니 아에, 트레 포 네마 팔리 둠, 우레아 플라스마 우레아 리티 쿰 등.
독성 연구
유전 독성 인간 림프구 분석, 마우스 골수 미세 핵 분석 및 마우스 시험 관내 림프종 세포 분석의 결과 아지트로 마이신은 돌연변이 유발 효과를 나타내지 않았다.
생식 독성 쥐와 생쥐의 생식 독성 시험에서 아지트로 마이신 (경구 투여) 용량이 중간 정도의 모체 독성을 유발하는 용량 수준에 도달 할 때 (즉, 200mg / kg / 일, 신체 표면적을 기준으로 약 500mg의 인간 용량) / kg / day가 2-4 배일 때 최기형성 효과는 관찰되지 않았습니다.
생식 능력과 태아에 대한 손상은 발견되지 않았습니다. 현재 임산부에게는 적절하고 엄격한 통제 된 임상 시험이 없습니다. 동물 생식 연구 결과가 항상 인간의 상태를 예측하는 것은 아니기 때문에, 아지트로 마이신은 실제로 필요할 때만 임산부가 사용할 수 있습니다. 이 제품이 모유로 분비되는지 여부는 알려지지 않았으며, 모유 수유중인 여성은 모유로 분비되는 약물이 많으므로주의해야합니다.
발암 성 아지트로 마이신 동물의 장기 사용의 발암성에 대한 연구는 없습니다.
[약동학]
경구 투여 후 빠르게 흡수되며 생체 이용률은 37 %입니다. 0.5 g의 단일 용량의 경구 후, 피크 시간은 2.5 내지 2.6 시간이고, 피크 혈장 농도 (Cmax)는 0.4 내지 0.45 mg / L이다. 이 제품은 신체에 널리 분포되어 있으며 각 조직의 농도는 같은 기간에 혈중 농도의 50 배에 도달 할 수 있으며 대 식세포와 섬유 아세포의 농도가 높으며, 아지트로 마이신을 염증 부위로 운반 할 수 있습니다. 단일제 투여 후의 혈액 제거 반감기 (T1 / 2)는 35 내지 48 시간이고, 투여 량의 50 % 초과가 원래 형태의 담도를 통해 배출되고, 원래 형태의 약 4.5 %가 투여 후 72 시간 내에 소변을 통해 배출된다. 이 제품의 혈청 단백질 결합률은 혈중 농도 증가에 따라 감소하며, 혈액 농도가 0.02μg / ml 일 때 혈청 단백질 결합률은 15 %이며, 혈액 농도가 2μg / ml 일 때 혈청 단백질 결합률은 7 %. 음식은이 제품의 생체 이용률에 영향을 미치지 않습니다.
[보관] 건조한 장소에 차광, 밀봉 및 보관.
[포장] 알루미늄 플라스틱 포장, 6 개 / 상자, 12 개 / 상자.
[유효 기간] 24 개월.
[집행 표준] 2010 년 중국 약전 제 2 판.
[승인 번호] National Drug Standard H20020729.
[제조업체]
회사 명 : Lunan Beite Pharmaceutical Co., Ltd.
생산 주소 : 산 동성 린이시 음 que 산로 243 호
우편 번호 : 276006
전화 번호 : 0539-8336336 (판매) 0539-8336337 (품질 파이프 부서)
팩스 번호 : 0539-8336029 (판매) 0539-8336338 (품질 파이프 부서)
웹 사이트 : www.LUNAN.com.cn
24 시간 고객 서비스 핫라인 : 400-0539-310

